L'atome: La
théorie atomique
L'atome: La
théorie atomique
Logiciels et bibliographie
Programme d'étude
Cours
L'atome
- La théorie atomique
- Structure de l'atome
- Propriétés de l'atome
- Exercices
Par exemple il est facile de comprimer ou dilater un gaz, ceci semble indiquer que ceux-ci sont composés de particules très espacées.
| Modèle | Commentaire |
 Atome |
L'atome est une boule |
Durant presque tout le 19ème siècle il n'existait aucune preuve observable de la réalité des atomes. C'est seulement en 1863, avec l'interprétation d'une expérience faite 40 ans avant par un botaniste, Robert Brown, qu'une manifestation concrète de leur réalité a été mise en évidence:
Robert Brown avait observé que lorsque de très fines particules se trouvent dans un liquide, elles sont continuellement agitées (on appelle encore aujourd'hui ce phénomène le "mouvement Brownien"). Ce mouvement est dû au bombardement inégal des particules par les molécules d'eau environnantes. Pour de gros objets un léger déséquilibre entre les molécules qui frappent à gauche et à droite est sans conséquence. Par contre pour de très petits objets ce léger déséquilibre peut causer une agitation perceptible.
L'électricité est encore très mystérieuse au 19ème siècle et plusieurs savants l'étudient.
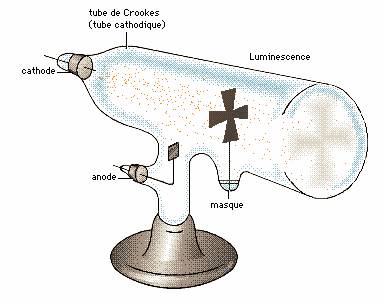 |
En 1854 un souffleur de verre allemand inventa une pompe à vide efficace. Ceci va permettre de nouvelles expériences. En plaçant deux électrodes dans un tube sous vide et en produisant des décharges électriques, on observe sur la paroi en face de l'électrode négative l'apparition d'une lueur verte. On appela ceci le rayonnement cathodique. |
Crookes améliora encore ce tube et montra que ce rayonnement était dévié par un aimant.
Il apparut que ce rayonnement était formé de particules chargées négativement. La déviation est telle que ces particules doivent avoir une masse très faible, beaucoup plus faible que l'atome. L'atome n'est donc pas la plus petite particule. On appela cette nouvelle particule l'électron.
| Modèle | Commentaire |
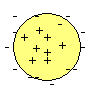 |
Etant donné qu'il est facile avec relativement peu d'énergie d'extraire des électrons de l'atome, il est naturel de conclure que ceux-ci se trouvent à la périphérie de l'atome. De plus il doit exister dans l'atome une charge positive puisque il est électriquement neutre. |
Avogadro, chimiste italien, déduit que dans un gaz, comme les atomes sont très éloignés les uns des autres en comparaison de leur taille, on peut dire que dans un même volume, il y a le même nombre de "grains" de matière. Cette déduction va permettre de comparer les masses des éléments.
Quand Becquerel
découvrit la radioactivité, il identifia facilement certains des
rayonnements émis par les corps radioactifs comme étant des électrons,
mais il y avait encore d'autres types de rayonnements.
Les Curie en trouvèrent notamment un, le rayonnement alpha.
|
|
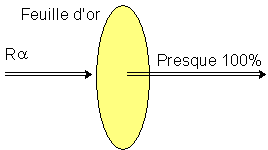
Vers 1907, Rutherford bombarda de fines feuilles d'or avec des rayons alpha et il constata que la plupart traversaient la feuille sans encombre (il y en avait tout de même quelques uns qui étaient déviés ou même renvoyés en arrière). |
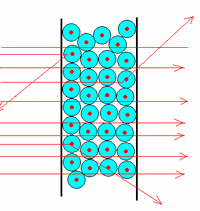 |
Cette expérience démontre que l'atome est essentiellement constitué d'espace vide. |
| Modèle | Commentaire |
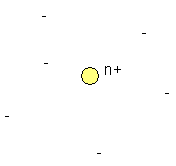 |
L'atome neutre est constitué par un noyau dur beaucoup plus petit que lui et contenant un nombre de charges positives égal au nombre d'électrons qui se trouvent dans un grand espace vide autour du noyau. |
Si onn pose que l'atome d'hydrogène a une masse de 1, comme il possède 1 électron et que celui-ci est très léger par rapport au noyau, on en déduit que la masse d'une charge positive, le proton est de 1.
Deux problèmes surgirent rapidement:
- le noyau de l'hydrogène a une masse d'environ 1 et une charge de +1. Le noyau est donc constitué d'un proton de masse 1. Pour l'hélium la charge est de +2 mais sa masse est d'environ 4. D'ou vient cette différence?
- D'après les mesures du poids atomique, la masse de l'atome de chlore est de 35,5. Aucun chercheur ne pouvait accepter l'idée d'un demi proton
Le deuxième problème fut résolu en premier et expliqua le premier: le noyau contient deux sortes de particules, une positive et une neutre de masse semblable, le neutron.
| Aujourd'hui on peut dire qu'on a enfin réussi à observer l'atome grâce au microscope ionique à effet de champ, qui a été inventé en 1955. |  |