 L'atome:
Propriétés de l'atome
L'atome:
Propriétés de l'atome
Logiciels et bibliographie
Programme d'étude
Cours
L'atome
- La théorie atomique
- Structure de l'atome
- Propriétés de l'atome
- Exercices
Deux atomes ayant exactement le même "bord" auront exactement les mêmes propriétés chimiques.
Aux frontières de l'atome se trouvent les électrons. Si deux atomes ont le même nombre d'électrons, ils n'ont cependant pas forcément les mêmes propriétés chimiques car si le nombre de protons varie, l'attraction des électrons pour le noyaux n'est pas la même.
Pour que deux atomes aient exactement les mêmes propriétés chimiques, il faut donc qu'ils aient le même nombre de protons et d'électrons, le nombre de neutrons par contre peut varier car ceux-ci n'influencent pas les bords de l'atome. Si le nombre de neutrons varie, cela change la masse de l'atome, qui est une propriété physique.
Exercice 1: Parmi
les atomes suivants:
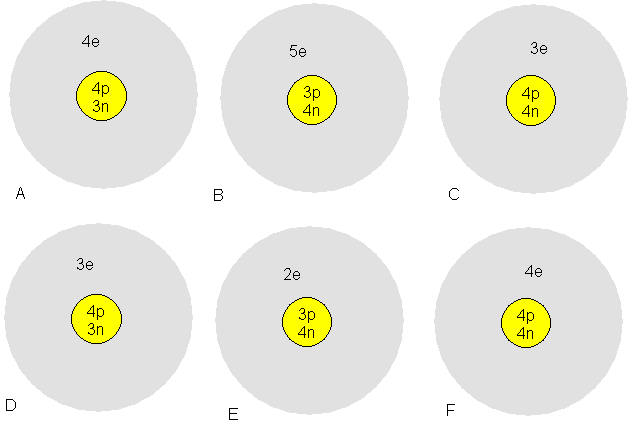
a) Lesquels ont les mêmes propriétés chimiques?
b) Lesquels ont environ la même masse?
c) Lesquels sont neutres?
d) Lesquels sont positifs?
e) Lesquels sont négatifs? 
Les forces qui lient les protons et neutrons (=nucléons) sont très grandes et ne peuvent être modifées dans des conditions "normales" sur terre. Des réactions avec ce genre de modifications s'appellent des réactions nucléaires et on ne s'en occupe pas ici.
Les électrons par contre sont moins fortement liés et peuvent être "arrachés" ou "donnés" à un atome lors d'une réaction chimique.
Quand un atome a un nombre de proton différent du nombre d'électron, on dit que c'est un ion, s'il est chargé positivement on parle d'un cation, s'il est chargé négativement on parle d'un anion.
Un élément
est défini comme l'ensemble des atomes qui ont les mêmes propriétés
chimiques quand ils sont neutres. Un élément est donc composé
de tous les atomes ayant le même
nombre de protons. Si le nombre de neutrons varie,
on parle d'isotopes
différents du même
élément. 
La notations complète d'un atome est la suivante:
|
Pour le symbole de l'élément (X), il faut se réfèrer au tableau périodique des éléments. Dans ce tableau chaque élément, qui correspond à un nombre déterminé de protons, occupe un case dont la numérotation correspond au nombre de protons (Z). Par exemple avec 6 protons, c'est la case numéro 6, elle correspond à l'élément carbone qui a pour abbréviation "C". La charge peut se représenter de plusieurs manières: ++ ou 2+ par exemple, pour un atome neutre, on indique rien. |
Exercice 2: Pour les
atomes suivants:
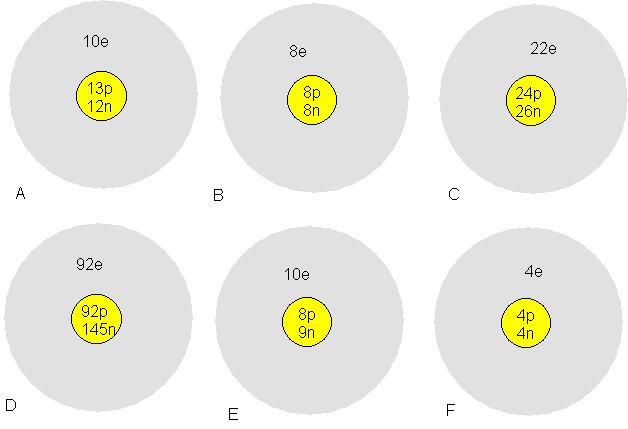
a)Donner la notation complète de ces atomes.
b) Lesquels ont les mêmes propriétés chimiques?
c) Lesquels sont des isotopes d'un même élément?
d) Lesquels sont des cations?
e) Lesquels sont des anions? 
Il existe peu d'isotopes stables pour chaque élément. Les masses atomiques du tableau périodique indique la masse moyenne pondérée des isotopes naturels.
Exercice
3: Une classe est composée de 15 élèves de 50 kg, et 8 de
60 kg. Quelle est la masse moyenne pondérée d'un élève de la classe? 
Les
isotopes instables se décomposent avec le temps par un phénomène appelé
radioactivité. Le temps pour que la moitié de l'échantillon se
décompose est fixe. Par exemple pour le carbone 14, la moitié se
décompose en 5400 ans. En mesurant la quantité qu'il reste dans un
échantillon, on peut donc déterminer l'âge de l'échantillon.
Les
isotopes d'un élément ont les mêmes propriétés chimiques, ceci est très
utile car cela permet de "marquer" des molécules pour suivre leur
cheminement, en recherche médicale par exemple.
Exercice 4: Pourquoi
les différents isotopes d'un élément
ont-ils les mêmes propriétés chimiques? 
