 Electrochimie -
Les piles
Electrochimie -
Les piles
Logiciels et bibliographie
Programme d'étude
Cours
Electrochimie
- Oxydation
- Nombre d'oxydation
- Réaction redox
- Equilibrage*
- Applications
- Potentiel redox
- Prévision de réaction*
- Corrosion
- Les piles
- Types de piles*
- Electrolyse*
- Exercices*
Dans une pile, on transforme de l'énergie chimique en énergie électrique.
Pour obtenir un courant électrique, il faut mettre des substances qui peuvent réagir ensembles (potentiel des demi-réactions positifs) en contact. Ceci non pas directement mais à l'aide de conducteurs de manière à pouvoir utiliser le courant d'électrons généré par la réaction redox.
Nous avons vu qu'il existe deux sortes de conducteurs, pour faire un circuit complet, on utilise un conducteur pour électrons (fil métallique) et un conducteur pour ions (solution d'électrolyte).
Construction d'une pile
Si nous avons du zinc en contact avec une solution de Cu++, voyons s'il y a une réaction:
Potentiel standards:
Zn2+ + 2e-  Zn E° =
- 0,76 V
Cu2+ + 2 e -
Zn E° =
- 0,76 V
Cu2+ + 2 e -  Cu
E° = 0,34 V
Cu
E° = 0,34 V
Le potentiel est supérieur pour le cuivre, il peut donc prendre des électrons au Zn et on a les réactions:
|
Demi-réaction |
Zn |
E° = 0,76 V |
|
Demi-réaction |
Cu++ + 2 e- |
E° = 0,34 V |
|
Réaction globale |
Cu++ + Zn |
ΔE° = 1.1 V |
Le potentiel de la réaction globale est positif, ce qui confirme que cette réaction est spontanée.
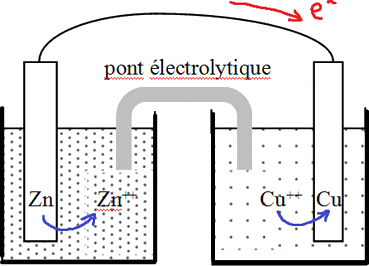 |
Dans un bécher nous plongeons
une
barre de zinc dans une solution de sulfate de zinc (ZnSO4).
Zn++/Zn forment ensembles un couple rédox.
Dans un autre bécher nous mettons une barre de cuivre dans une solution de sulfate de cuivre (CuSO4). Le couple rédox dans ce cas est formé de Cu++/Cu. Nous relions les deux métaux par un conducteur métallique externe permettant une circulation des électrons. Nous relions aussi les deux solutions d'électrolytes par un pont électrolytique qui permet de garder l'électroneutralité dans les deux béchers. |
Observations
Nous avons maintenant construit une pile, et nous remarquons:
-
qu'il existe une différence de potentiel entre les deux "électrodes" de cuivre et de zinc
-
qu'il y a un courant qui circule, ce courant va du cuivre au zinc (le sens conventionnel du courant va du plus au moins, donc l'inverse du sens des électrons)
-
que lorsque la pile débite un courant, il se produit une réaction chimique. La barre de cuivre s'épaissit et la concentration des ions Cu2+ diminue, et la barre de zinc s'amincit alors que la concentration des ions Zn2+ dans la solution augmente.
-
que l'intensité du courant débité diminue au cours du temps. Lorsqu'elle est devenue nulle, le système n'évolue plus chimiquement. La pile donnera du courant jusqu'à épuisement du zinc ou des ions cuivriques (Cu++).
Définitions
Une électrode est un solide par laquelle le courant électrique est introduit dans un liquide (ou solide ou gaz). Une électrode immergée dans une solution d'électrolytes constitue une demi-pile. En accouplant deux demi-piles on obtient une pile.
|
|
L'électrode
sur laquelle on observe
une réduction est
la cathode (c'est le pôle + pour une pile). L'électrode sur laquelle on observe un oxydation est l'anode (c'est le pôle - pour une pile). Les électrons vont du - au + et par convention le courant va du + au - |
Par convention, on représente une pile par le symbolisme suivant:
Zn(s) ׀ Zn2+(aq) ׀ ׀ Cu2+/aq) ׀ Cu(s)
Exercices
Exercice 1: On forme une pile en reliant deux demi-piles de Ni++/Ni et de Cd++/Cd par une jonction liquide contenant du nitrate de sodium (NiNO3) et par un circuit externe.
a) Quelle est la réaction globale de cette pile?
b) Quelle demi-réaction a lieu a chaque électrode?
c) Dessiner la pile.
d) Quelle est l'anode est la cathode?
e) Quelle est la direction du flux d'électrons dans le circuit externe et des anions dans la jonction liquide?

Exercice 2: Calculer
ΔE° pour des piles basées sur les réactions redox suivantes :
a) Cr3+ + Cl2  Cr2O72-
+ Cl-
Cr2O72-
+ Cl-
b) Cu2+ + Mg  Mg2+ + Cu
Mg2+ + Cu

Exercice 3: Quelle est la différence de potentiel standard
d'une pile formée des couples
a) Zn++/Zn
et Cu++/Cu. b)
Ni++/Ni
et Zn++/Zn
Ecrire les équations des réactions qui ont lieu à la
cathode et à l'anode.

Exercice 4: Déterminer
la f.é.m. d'une pile pour
laquelle la réaction globale est:
Fe(s)
+
Cd2+(aq)  Cd(s)
+
Fe2+(aq)
Cd(s)
+
Fe2+(aq)

Exercice 5: Les batteries de voiture sont constituée de
PbO2(s) ׀ Pb2+(aq) ׀
Déterminer sa force électromotrice.

Exercice 6: Pourquoi faut-il un pont électrolytique dans une pile ?

